ecuațiile ionice
ecuațiile ionice
După cum știți deja din lecțiile anterioare ale chimiei, cele mai multe reacții chimice au loc în soluție. Și, din moment ce toate soluțiile de electrolit includ ioni, este posibil să spunem că reacția din soluțiile de electrolit sunt reduse la reacțiile dintre ionii.
Acestea sunt reacțiile care au loc între ionii sunt numite reacții ionice. O ecuație ionică - este exact ecuația acestor reacții.
De regulă, ecuația ionică pentru reacția se obține din ecuațiile moleculare, dar acest lucru se supune acestor reguli:
• În primul rând, formule electroliții slabi, precum și substanțe insolubile și solubile slab, gaze, oxizi, etc. în care nu este înregistrată sub formă de ioni, o excepție de la această regulă este ion HSO-4, și apoi, în formă diluată.
• În al doilea rând, sub formă de ioni, sunt în mod tipic de acizi formule tari, alcalii, și sărurile solubile în apă. De asemenea, trebuie remarcat faptul că această formulă, ca și Ca (OH) 2 se prezintă sub formă de ioni, în acest caz, atunci când se utilizează apă de var. Dacă se utilizează laptele de var, care conține particule insolubile de Ca (OH) 2, formula sub formă de ioni nu sunt înregistrate.
La elaborarea ecuațiile ionice tind să folosească ion completă și prescurtată, adică o ecuație ionică scurtă. Dacă luăm în considerare ecuația ionică, care este o formă prescurtată, atunci noi nu observăm ionii, adică nu există pe ambele părți ale ecuației totale de ioni.
Să ne uităm la exemple de ecuatii ionice cum moleculare scrise, lungi și scurte:
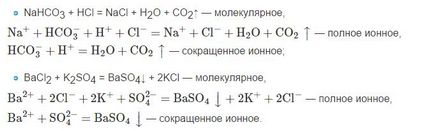
Prin urmare, trebuie amintit că formulele de substanțe care nu se sparg, precum ionul insolubil și gazos în prepararea ecuațiilor scrise de obicei sub formă moleculară.
De asemenea, trebuie amintit că, în cazul în care substanța este precipitat, următoarea cu formula reprezintă săgeata în jos (↓). Ei bine, în cazul în care substanța gazoasă din formula următoare ar trebui să fie astfel o pictogramă este o săgeată orientată în sus (↑) este eliberat în timpul reacției.
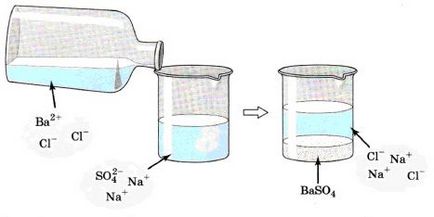
Să aruncăm o privire mai atentă la un exemplu. Dacă avem o soluție de sulfat de sodiu Na2SO4, și noi se adaugă la soluția de BaCl2 clorură de bariu (Fig. 132), vedem că ne-am format un precipitat alb de sulfat de bariu BaSO4.
Priviți cu atenție imaginea care arată interacțiunea dintre sulfat de sodiu și clorură de bariu:
Acum să scrie ecuația de reacție moleculară:
Ei bine, acum să rescrie această ecuație în care electroliți puternici sunt reprezentate ca ionii, iar reacțiile care ies din domeniul de aplicare, sunt prezentate sub formă de molecule:
Înainte am înregistrat ecuația ionică completă.
Acum vom încerca să eliminați una dintre m cealaltă parte a ecuației aceeași ioni, adică acei ioni care nu participă la reacție 2Na + 2CI și apoi vom obține ecuația ionică prescurtată, care va avea următoarea formă:
Din această ecuație observăm că întreaga esență a acestei reacții este redusă la interacțiunea ionilor de bariu Ba2 + și ioni sulfat
și BaSO4 precipitat care se formează nu este chiar indiferent dacă un rezultat, în electrolit, care a inclus acești ioni înainte de reacție.
Cum de a rezolva ecuația ionică
Și, în sfârșit, să recapitulăm lecția și de a determina modul în care este necesar pentru a rezolva ecuația ionică. Știm deja că toate reacțiile care au loc în soluții de electroliți între ionii sunt reacții ionice. Aceste reacții sunt luate pentru a rezolva sau descrise cu ajutorul ecuațiilor ionice.
De asemenea, rețineți că toți acei compuși care sunt volatile, este greu solubilă sau little- disociate găsi o soluție sub formă moleculară. De asemenea, nu trebuie uitat faptul că, în cazul în care interacțiunea soluției de electrolit este formată din oricare dintre tipurile de mai sus de compuși, aceasta înseamnă că reacțiile practic nu apar.
Termenii de soluții ionice de ecuații
Pentru un exemplu vizual, să ia o educație greu compuși solubili, cum ar fi:
Na2SO4 + BaCl2 + = VaSO4 2NaSl
Forma ionică a expresiei va fi:
2Na + + SO42- + Ba2 + + 2Sl- = BaSO4 + 2Na + + 2Sl-
Din moment ce vedem că în reacție pentru a lua o ioni de bariu și ioni sulfat, și alți ioni care nu au reacționat și starea lor a rămas aceeași. Din aceasta rezultă că putem simplifica ecuația și scrie în formă prescurtată:
Ba2 + + SO42- = VaSO4
Acum, să ne amintim că ar trebui să luăm în relațiile cu ecuațiile ionice:
• În primul rând, este necesar să se excludă din ambele părți de către aceeași ioni;
• În al doilea rând, nu trebuie să uităm că suma sarcinilor electrice ale ecuației trebuie să fie aceeași, iar în partea dreaptă, și, de asemenea, în partea stângă.