Polaritatea moleculelor (tipuri de molecule covalente)
Este necesar să se distingă polaritatea moleculelor de polaritatea conexiunii. Pentru molecule diatomice tip AB, aceste concepte sunt aceleași ca deja arătat în moleculă Exemplul HCI. In astfel de molecule, mai mari diferența de elemente electronegativitate (# 8710; EO), mai mari momentul de dipol electric. De exemplu, într-o serie de HF, HCI, HBr, HI scade în aceeași secvență ca electronegativitatea relativă.
Moleculele pot fi polare și nepolare, în funcție de natura distribuției densității de electroni a moleculei. Moleculele polarității caracterizate prin valoarea momentului de dipol electric # 956; m. care este egală cu suma vectorială a momentelor de dipol electrice de obligațiuni și perechi nonbonding de electroni în molecule. Rezultatul plus depinde de polaritatea conexiunilor, structura geometrică a moleculei, prezența perechilor de electroni neîmpărtășite. mare influență asupra polaritatea moleculei are simetrie acesteia.
De exemplu, molecula de CO2 liniar are o structură simetrică:
Prin urmare, în timp ce C = O și au un caracter puternic polar, datorită compensării reciproce a momentelor lor de dipol electrice ale moleculei de CO2, în general, non-polare (). Din acest motiv, nepolare molecula de CH4 tetraedral foarte simetrică. CF4. molecula octaedrice SF6 și t. d.
Dimpotrivă, în colțul H2O obligațiuni polare molecule O-H sunt înclinate 104,5º. Prin urmare, momentele lor nu se anulează reciproc, iar molecula este polară ().
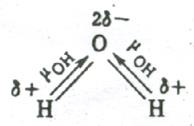
moment de dipol electric prezintă, de asemenea, molecule de SO2 unghiular. Moleculele piramidale NH3. NF3 și t. D. Absența unui astfel de moment
indicativ de structură foarte simetrică a moleculei, prezența momentului de dipol electric - (. vezi Tabelul 3.2) asimetria structurii moleculare.
Structura și polaritatea așteptată a moleculelor
La valoarea momentului de dipol electric al moleculelor influențează puternic perechilor de electroni nonbonding. De exemplu, moleculele de NH3 și NF3 sunt la fel de formă trigonal-piramidală, obligațiuni polaritate N-H și N-F, de asemenea, aproximativ la fel. Cu toate acestea, dipol momentul electric de NH3 este de 0,49 · 10 -29 m · CI, NF3 și 0,07 · 10 -29 · Cl m. Acest lucru se datorează faptului că direcția NH3 a momentului de dipol electric N-H de legare și perechea de electroni nonbonding coincide cu adăugarea vector conduce la un mare moment de dipol electric. Pe de altă parte, în momentele de obligațiuni NF3 N-F și perechea de electroni în direcții opuse, astfel încât acestea sunt parțial compensate în plus (fig. 3.15).
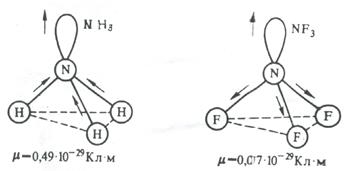
Figura 3.15. Adăugarea momentelor dipol electric de unire și perechilor de electroni nonbonding de molecule de NH3 și NF3
molecula nepolară poate fi polar. Pentru a face acest lucru, trebuie să fie plasat într-un câmp electric cu o anumită diferență de potențial. Câmpul electric „centre de greutate“ de sarcini pozitive și negative sunt deplasate și nu este indus sau indusă moment de dipol electric. La scoaterea din nou câmpul devine o moleculă nepolar.
Sub influența unui câmp electric extern este o moleculă polară este polarizată, adică. E. apare Există redistribuire de încărcare, iar molecula devine noua valoare a momentului de dipol electric devine și mai polar. Acest lucru se poate produce sub influența câmpului creat abordat molecula polară. Capacitatea moleculelor polariza sub influența unui câmp electric extern numit polarizabilitatea.
Polaritatea și polarizabilitatea a moleculelor datorate interacțiunilor intermoleculare. Cu momentul de dipol electric al moleculei legat substanța reactivitatea, solubilitatea sa. moleculele lichide polare favorizează disocierea electrolitică a electroliților dizolvate în ele.
Când doi atomi, având diferite electronegativities, perechea de electroni totală poate fi deplasată practic complet la atomul cu electronegativitate mai mare. Ca rezultat două particule încărcate - doi ioni, care acționează între forța atracție electrostatică.
Feedback, care este implementat prin formarea unei interacțiuni electrostatice și ioni încărcați opus, numit ion.
De exemplu, o legătură ionică are loc între cesiu și fluor, în care EO diferența este mai mult de trei unități. Compușii tipici având o legătură ionică includ halogenuri de metale alcaline, cum ar fi CsF, CsCl, NaCI.
Liantul ionic se caracterizează prin:
- Omnidirecțională. deoarece câmpul electric are un caracter ionic sferic și echivalente în toate direcțiile;
- nesaturat. ca și în interacțiunea dintre ionii nu are loc de compensare reciprocă completă a câmpurilor de forță (Fig. 3.16) ionii și păstreze capacitatea de a interacționa cu alți ioni electrostatică.
Din cauza lipsei orientării legăturii ionice și saturability fiecare ion este înconjurat de ioni de semn opus, număr care este determinat de mărimea și forța repulsivă de ioni încărcate, cum ar fi. De aceea, compuși cu legături ionice sunt substanțe cristaline. Întregul cristal poate fi privit ca o singura molecula gigant constând dintr-un număr foarte mare de ioni. Numai la temperaturi ridicate, atunci când substanța trece în stare gazoasă, compuși ionici pot exista în moleculele neasociaþi formă.
Teoria legăturii ionice dezvoltat în 1916 de către savantul german W. Kossel. Conform acestei teorii, configurația stabilă este o manta al unui gaz inert s 2 p 6. Toți atomii care participă la interacțiune chimică, caută să achiziționeze un pachet stabil de gaz inert. Când acest atomii de metal dau electronii de valență, dobândind precedent plic de gaz inert și o sarcină pozitivă. atomii metaloid accepta electroni, dobândind plic ulterior de gaz inert și o sarcină negativă. De exemplu:
K 2 3s 4s 3p 6 1 - 1e # 713; K + 3s 2 3p 6;
F 2s 2 2p 5 + 1e # 713; F 2s 2 2p 6.
transferul complet al unui electron de la un atom la altul, în realitate, nu are loc, chiar și în compuși ionici tipici - halogenuri alcaline. De exemplu, într-un cristal de NaCl eficient atom de sarcină negativă clor este responsabil numai 0,94 electron; aceeași în valoare absolută are o sarcină pozitivă și un atom de sodiu. Este imposibil să se realizeze o graniță precisă între legătură ionică și o legătură covalentă polară, numai gradul de ionicity al legăturii poate fi evaluată, care este cuantificat prin sarcinile efective ale atomilor (d) în moleculă. Putem spune că legătura ionică este un caz de limitare a legăturilor covalente polare pentru care taxa efectivă a atomilor în valoare absolută apropiate de unitate. Este considerat o legătură ionică, în cazul în care diferența în electronegativities de atomi (DEO) este mai mare decât 1,9 sau ½d½> 0,5. Astfel, natura legăturii chimice este una și există o distincție între tipurile de conexiuni este cantitativ.
1.Iony au un efect polarizant - abilitatea de a deforma pentru a înlocui coajă de electroni ionul adiacent. Într-o mare măsură, ei au această proprietate cationi. Acțiunea polarizator depinde, în primul rând, pe raza de încărcare și de ioni, cu atât mai mare taxa și raza de ioni mai mici, mai puternic efectul său polarizator. De exemplu:
a) Pb 0 Pb 2+ Pb 4+
r, Å 1,74 1,32 0,84
efect polarizant este îmbunătățită;
b) Li + Na + K + Rb + Cs +
ioni rază crește, efectul de polarizare este redus.
În al doilea rând, cei mai mulți electroni pe cation de metal are nivelul de energie exterioară, cu atât mai mult efectul său polarizator. De exemplu, printre: Ca 2+ (8e # 713;) 1, Fe 2+ (14e # 713;), Zn 2+ (18e # 713;) efectul polarizant al ionilor crește.
2. polarizabilitatea - ion este abilitatea de a se deforma sub acțiunea câmpului electric adiacent unui ion. Y ionilor cu aceeași sarcină și aceeași structură a învelișului exterior al electronilor crește odată cu creșterea dimensiunii polarizabilitatea ionilor. De exemplu:
a) Li + Na + K + Rb + Cs +
ioni crește raza, polarizabilitatea crește;
ioni crește raza, polarizabilitatea crește.
polarizat ionii mai usor incarcate negativ (anioni). Dimensiunile lor în comparație cu atomii crește, repulsia dintre electroni crește și crește polarizabilitatea. În primă aproximație, putem presupune că tulpina este supusă numai învelișul de electroni exterior al ionului.
Numele „legătura de metal“ înseamnă că ne vom concentra asupra structurii interne a metalelor.
Atomii de cele mai multe metale în nivelul energetic exterior conține un număr mic de electroni de valență în comparație cu numărul total de orbitali energetic aproape externe și cu valența de electroni Rhone datorită energiei de ionizare scăzută de slab a avut loc în atom. De aceea, energic mai avantajos ca electronii nu sunt localizate, și care aparțin tuturor metalelor. Astfel, un electron conține 16 elemente, iar doi - 58, trei - patru elemente și nici unul th - un singur Pd. atomi numai elementele Ge, Sn și Pb sunt la nivelul de electroni exterior 4, Sb și Bi - 5 și Ro - 6. Cu toate acestea, aceste elemente nu sunt caracteristice metalelor.
Elementele - metale formează substanțe simple. În condiții normale, această substanță cristalină (cu excepția mercurului). Conform teoriei „electroni liberi“ în porțiunile cu zăbrele metalice sunt ioni incarcati pozitiv, care sunt imersate într-un „gaz“ electronic, distribuite pe metalul de valență a electronilor nelocalizat. Dintre ionii metalici incarcati pozitiv si electroni non-localizate există interacțiuni electrostatice, oferind rezistență la substanțe.
Fig. 3.17 este o diagramă a rețelei cristaline a metalului de sodiu. Acesta fiecare atom de sodiu este înconjurat de opt atomi vecine. Un exemplu în acest sens, ia în considerare o substanță legătură metalică.
La un atom de sodiu, la fel ca toate metalele, are un exces de orbitali de valență și deficit de electroni. Astfel, de electroni de valență (3s 1), poate lua una dintre cele 9 orbitalii disponibile: 3s (unul), Sp (trei) și 3d (cinci). Când se apropie de atomi, având ca rezultat formarea de cristal cu zăbrele orbitali de valență ale atomilor adiacenți re-kryvayutsya, prin care electronii se deplasează liber dintr-un orbital la altul prin efectuarea comunicării între toți atomii metalici ai cristalului (fig. 3.18).
Astfel, legătura metalică - este puternic legătură chimică nelocalizat apare atunci când atomii de electroni de valență au puțin în comparație cu cantitatea de orbitali de valență liberă, iar electronii de valență ale energiei de ionizare redusă ținut slab de nucleu.
obligațiuni metalice are unele similitudini cu covalentă, deoarece se bazează pe o generalizare a electronilor de valență. Cu toate acestea, atunci când legătura covalentă rezumate doar doi electroni de valență de la vecine atomi, iar când legătura metalică din socializată-SRI acești electroni toți atomii participă. Este cristalul având o legătură covalentă fragilă, și un metal - plastic; în acest ultim caz, posibilitatea deplasării reciproce a ionilor și electronilor fără a rupe conexiunea. Acest lucru arată non-localizarea (prezența pe direcția) a îmbinării metalice. Disponibilitatea de electroni care se pot mișca liber în întregul volum al cristalului asigură o conductivitate ridicată electrică și o conductivitate termică, precum și ductilitate. luciu metalic, datorită reflexiei razelor de lumină din gazul de electroni, care este un pic dincolo de granițele ioni încărcați pozitiv. Este o legătură metalică explică proprietățile fizice ale metalelor.
Liantul metalic este caracteristic metale în stare solidă și lichidă. Această proprietate a agregatelor de atomi situate în imediata apropiere unul de altul. vaporizat Totuși atomii de metal, precum și toate substanțele sunt legate printr-o legătură covalentă. metale pary“constau din molecule individuale (de monohidroxilici și dihidroxilici). Forța de legătură în cristal decât într-o moleculă de metal, astfel încât formarea veniturilor cristal de metal cu eliberare de energie.