Polar și molecule non-polare
centre de putere de sarcini pozitive și negative în molecula nu coincid la un moment dat, dar sunt unele ℓ distanta.
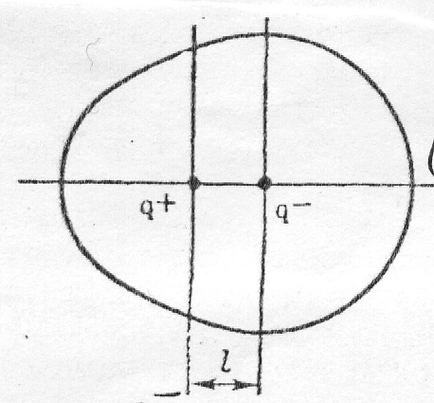
molecula Polar cu un moment de dipol electric permanent
O molecula cu o neutralitate globală reprezintă un dipol electric cu sarcină q - - atom de clor y și q + - atomul de hidrogen. Astfel de legături și molecule sunt numite polare. Taxe de atomi într-o moleculă numite taxe eficiente q (molecula HCl QCL = -0,18; qn = 0,18 și o sarcină absolută a unui electron, gradul de ionicity al legăturii
Măsură de conectare polaritate și molecula - un moment de dipol electric (μ - «mu") definit de produsul
μ = qℓ, CI ∙ m sau μ = qℓ / 3,33 ∙ 10 -30. D
unde q - sarcina efectivă; ℓ - lungimea de dipol. Unitatea a momentului de dipol electric (sistemul SI) este exprimat de 3.33 ∙ ∙ Cl 10 -30 m (Coulomb-metru) = 1D (D - Debye).
Electric dipole moment - o cantitate vector. Direcția de luat în mod convențional de la pozitiv la sarcina negativă - în direcția de deplasare a norului de electroni liant. Cu cât diferența de elemente electronegativitate molecule polare, cel mai mare moment de dipol electric.
Pentru moleculele poliatomice, trebuie să distingem conceptul de momente de dipol de obligațiuni individuale și molecula ca întreg. Deoarece prezența legăturilor multiple în moleculă, momentele lor de dipol sunt formate conform regulii paralelogramului, în funcție de forma moleculei definită prin conexiuni orientate momentul dipolar rezultantă diferă de dipol momente ale patinelor individuale, în caz particular (pentru extrem de molecule) poate fi zero, în ciuda o polaritate semnificativă de obligațiuni individuale. De exemplu, molecula de CO2 liniar non-polar (μ = 0), în timp ce fiecare C = O legătură are un moment de dipol semnificativ (μ = 2,7 D).
2.7 D 2.7 d
Molecule care conțin o legătură covalentă non-polar, numit non-polar sau homopolar. Astfel de molecule de legare sunt distribuite simetric nor de electroni între nucleele celor doi atomi, iar nucleul acționează în mod egal pe ea. Exemplele includ substanțe simple ale moleculei, care constau din atomi de un singur element: H2. Cl2. O2. N2. F2 și altele. dipol electric moment de molecule este zero.
Capacitatea moleculelor (și obligațiuni individuale) polariza sub influența unui câmp electric extern numit polarizabilitatea. Acest lucru se poate produce sub influența câmpului creat abordat molecula polară. Prin urmare, polarizabilitatea este de mare importanță în reacții chimice.
Este întotdeauna important să se ia în considerare polaritatea moleculei și momentul său de dipol electric. Cu cea mai recentă reactivitatea corespunzătoare a substanțelor. In general, cu cât dipol momentul electric al moleculei, cu cât reactivitatea compusului. Cu un moment de dipol electric, acesta este, de asemenea, substanțe și solubilitate aferente. lichide polare sunt favorabile electrice molecula de disociere a electroliților dizolvate în ea principiul „cum ar fi ca se dizolva“.