obligațiuni Sigma și PI - Marea Enciclopedie sovietică
C și gma- și link-pi-I comunicare (e - și p -bond), legături chimice covalente. caracterizat printr-o anumită, dar diferit de electroni spațială simetrie distribuției densității. După cum se știe, legătura covalentă formată prin schimbul de electroni care interacționează atomii. Rezultat nor de electroni s -bond link simetric față, adică. E. Linia de legătură a nucleelor. Conexiune simplă în compuși chimici sunt, de obicei (t-obligațiuni (vezi. Conexiunea simplă). Cloud electroni p -bond simetric în raport cu un plan care trece prin link-ul (Fig. 1 b), și în acest plan (numit un nod), densitatea de electroni este . folosirea la zero litere grecești s și p este legat de conformitatea literelor latine s și p electroni atom desemnare la participarea care devine mai întâi posibilă formarea s. - și p respectiv -bonds deoarece norii atomice p-orbitali (px py pz ... ) sunt simetrice în raport . Tel'nykh axele respective de coordonate carteziene (x, y, z), atunci în cazul în care un p orbital, de exemplu, pz participă la formarea -bond s (axa z - link) (. Px py), cele două orbitalii p rămase Can pentru a participa la formarea a două -bonds p (xz planul lor nodal și yZ sunt, respectiv, a se vedea figura 2 ..) în formarea s și p -bonds pot participa ca d- (a se vedea figura 1 ..) și un atom de f-electroni. .
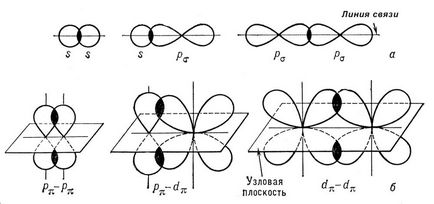
Fig. 1. Reprezentarea schematică a orientării spațiale a orbitalii în formarea s -bond care rezultă s - S-, s - p S-. p s - interacțiunile p s este (a) și p p p -bond rezultat -. p p -. d p - d p - interacțiuni (b).
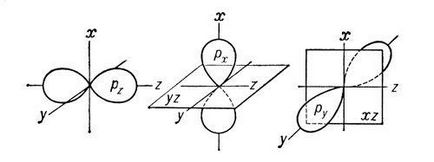
Fig. 2. Reprezentarea schematică a norilor px -, ru -, pz - electroni. Se afișează axa de coordonate carteziene și px planul nodal - py și orbitali.
