Ionic ecuație - studopediya
Cele mai multe reacții chimice în soluții. soluții de electroliți conținând ioni, și, prin urmare, soluțiile de reacție de electroliți sunt efectiv reduse la reacțiile dintre ionii.
Reacțiile dintre ionii sunt numite reacții ionice, și ecuațiile de astfel de reacții - ecuațiile ionice.
Când ecuația de ioni preparare trebuie să fie ghidate de faptul că insolubilele formula malodissotsiiruyuschih și gazoase înregistrate sub formă moleculară.
Substanța albă precipitat, apoi lângă revendicările puse săgeată în jos, iar în cazul în care este eliberat în timpul substanța gazoasă reacție, apoi lângă revendicările puse săgeată.
Noi rescrie această ecuație, ilustrând electroliți puternici sub formă de ioni, și se întinde din reacția - sub forma de molecule:
Am înregistrat ecuația ionică atât de completă.
Dacă excludem din cele două părți ale acelorași ioni, care nu este implicat în reacție la partea stângă și dreaptă a ecuației), obținem o ecuație ionică redusă:
Astfel, ecuațiile ionice reduse sunt ecuații într-o formă generală, ce caracterizează natura reacției chimice indică care ionii reacționează și o substanță formată ca rezultat.
reacții de schimb ionic continua să se încheie în cazurile în care a format sau precipita sau substanță malodissotsiiruyuschee cum ar fi apa. Blanșarea la o soluție de hidroxid de sodiu, cu fenolftaleina pătată purpura, surge soluție de acid azotic în exces, soluția este decolorată, care semnalează reacția chimică:
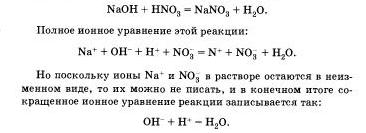
Acesta arată că interacțiunea dintre acidul tare și alcaliilor reduce interacțiunea dintre ioni H + și OH - ioni, având ca rezultat formarea substanței malodissotsviruyuschee - apă.
Respectiva reacție dintre un acid puternic și alcalină numită reacție de neutralizare. Acesta este un caz special al reacției de schimb.
O astfel de reacție de schimb poate avea loc nu numai între acizi și baze, dar, de asemenea, între acizii și bazele insolubile. De exemplu, dacă primesc un precipitat insolubil albastru de hidroxid de cupru (II) sulfat de cupru II prin reacția cu un alcalin:
și apoi se împarte precipitatul rezultat în trei părți și creșterea bruscă a precipitatului în soluția de acid sulfuric primul tub pentru a precipita o a doua soluție de acid clorhidric tub, și la reziduu, în al treilea tub o soluție de acid azotic în toate cele trei flacoane precipitat dizolvat. Acest lucru ar însemna că, în toate cazurile în trecut o reacție chimică, care reflectă esența și cu ajutorul aceleiași ecuații ionice.
Pentru a vedea acest lucru, notați moleculare, lungi și scurte ecuațiile ionice reacțiile date.
Luați în considerare reacțiile ionice care au loc cu formarea de gaz. Cele două tuburi se toarnă 2 ml de carbonat de sodiu și carbonat de potasiu. Apoi, în soluția clorhidric pentru prima captură, iar al doilea - azotic acid. În ambele cazuri, observăm caracteristica „fierbere“, datorită dioxidului de carbon emis. Scriem ecuația de reacție pentru primul caz:
Reacțiile în soluțiile electrolitice, eapis cabina cu ajutorul ecuațiilor ionice. Aceste reacții sunt numite reacții schimbătoare de ioni, ca și în soluții de electroliți schimb de ioni lor. Astfel, două concluzii pot fi trase.
1. Reacțiile în soluții apoase de electroliți sunt reacții între ionii, și de aceea descrisă ca ecuațiile ionice.
Ele sunt mai ușor de moleculara si sunt mai generale.
2. Reacția de schimb ionic în soluții de electrolit substanțial ireversibil continua numai dacă precipitatul rezultat format gaz malodissotsiiruyuschee sau substanță.