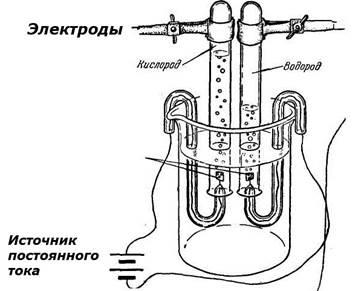
Electroliza - studopediya
Electroliza - un set de reacții redox care au loc la electrozi în timpul trecerii unui curent electric continuu printr-un sistem electrochimic format din doi electrozi și soluție de electrolit sau topi.
In electroliza, o reacție chimică prin energia curentului electric. La catod, electrodul negativ (-), există un proces de recuperare, la anod, un electrod încărcat pozitiv (+) - procesul de oxidare. Acțiunea reductivă și oxidativă a curentului electric mai puternic decât efectul agenți chimici de reducere și agenți de oxidare. Dispozitivul, care se realizează electroliza, numit electrolizor sau baia electrolitică. Natura fluxului în procesele de electrod de electroliză este influențată în mare măsură de compoziția electrolitului, solventul, materialul de electrod și condițiile de electroliză (tensiune, densitatea de curent, temperatura, etc.).
Distinge electroliza topiturilor și soluții de electrolit. În acest ultim caz, în procesul de electroliză va implica molecule de apă.
Electroliza se topește.
Dacă topitura de clorură de sodiu se scufundă electrozi inerți (cărbune, fier) și pentru a trece curent electric direct, ionii se vor deplasa la electrozii: Na + cationi la catod, anionii Cl - - la anod.
Oxidarea are loc la recuperarea anodului are loc la catod (cuvinte care încep cu o vocală „a“) (cuvântul începe cu un „k“ consoană).
Anionii - ioni încărcați negativ. Cationii - ioni incarcati pozitiv.
ionii de sodiu Na +. ajunge la catod, electronii sunt luate din ea și restaurat; clor ionii Cl -. oferind electroni Anod oxidat. Ecuația totală electroliză
NaCl → Na + + Cl -
(-) catod: Na + Na + + e → Na
(+) Anod: Cl - 2CI - - 2e → Cl2
Schema totală a procesului de electroliză topi NaCl 2NaSl → 2Na + Cl2.
In electroliza topiturilor conținând anioni conținând oxigen, oxigenul este dezvoltă la anod. Acest lucru se datorează formării în oxidarea la particulele instabile anod OH -. SO4 2-, etc. imediat descompus în oxid metaloid stabil și oxigen.
Schema se topesc electroliza de sulfat de sodiu poate fi reprezentat după cum urmează:
(-) catod: Na + 2Na + + 2e → 2 Na
Schema totală a procesului de electroliză se topesc Na2 S04
Electroliza a soluțiilor.
Atunci când se analizează electroliza soluțiilor apoase trebuie amintit că, în plus față de moleculele de electrolit, moleculele de apă pot fi supuse unei oxidări electrochimice sau reducere. În acest caz, este necesar să se ia în considerare valoarea capacității procesului de recuperare a ionilor de hidrogen, care este dependentă de concentrația de H +. În mediu neutru valoarea este -0.41 cationii V. Secvență deversează electroliza poate fi setat folosind seria de tensiune electrochimică.
1. Cationii metalelor cu potențial de valoare considerabil mai negativă decât -0.41 V (potențial de evoluție a hidrogenului) este redus la catod (inclusiv litiu la aluminiu) și moleculele de apă sunt reduse;
2. Cationii metalelor cu un electrod valoare potențial standard, apropiat de valoarea evoluția hidrogenului potențial (partea de mijloc a unui Zn metale serie, Cr, Fe, Cd, Ni) sunt reduși la catod, împreună cu moleculele de apă;
3. Cationii metalelor având un potențial standard de electrod mai mare decât potențialul de evoluție a hidrogenului, electroliza practic complet reduși la catod.
Când soluția apoasă conține cationi de metale diferite, selectarea electroliza catod va curge în ordinea valorilor algebrice ale potențialului de electrod standard, descendent. Astfel, un amestec de Ag + cationi. Cu 2+. Fe 2+ se va recupera mai întâi cationi de argint (E o = + 0,80 V), apoi cationii de cupru (E o = 0,34 V), iar ultima - cationii de fier (E o = - 0,44 V). Natura reacțiilor care apar la anod depinde de prezența moleculelor de apă, iar pe materialul din care este confecționat anodul. Distinge anozi insolubili și solubili.
anozi insolubili grafit, platină. In electroliza, anozi insolubili nu trimit electroni la un circuit extern, realimentarea lor se realizează prin oxidarea anioni și molecule de apă. În acest caz, anionii acizilor hidrogen atunci când sunt concentrații suficiente de oxidate destul de ușor. Dacă soluția conține anioni ai acizilor conținând oxigen (SO4 2- NO3 -.... CO3 2- și PO4 3- etc.), atunci anodul nu este oxidat ionii și moleculele de apă.
În funcție de pH-ul soluțiilor de oxidare a apei are loc în mod diferit. Într-un mediu alcalin, există o reacție 4 întrucât - - 4a = O2 + 2H2 O.
Acida sau neutru mediu 4e + 2H2O = O2 + 4H +.
În aceste cazuri, oxidarea electrochimică a apei este procedeul cel mai energic favorabil. anioni sau cu conținut de oxigen nu sunt capabili să oxideze, sau oxidarea acestora are loc la potențiale foarte mari. De exemplu, potențialul de oxidare a ionilor SO4 2-
Acesta este egal cu 2,01 V, care este semnificativ mai mare decât potențialul de oxidare a apei 1,23 V.
În cazul unui anod insolubil, electronii din circuitul extern trimite anod în sine. anozi solubili sunt realizate din cupru, argint, zinc, cadmiu și altele.
Luați în considerare mai multe exemple de electroliza soluțiilor apoase de electroliți. Electroliza soluției concentrate de iodură de potasiu cu electrozi de carbon.
În soluție sunt ioni gidrotirovannye și K + J -. precum și o moleculă de apă. Când curentul curge printr-o soluție de K + cationilor muta spre catod, anionii J - - la anod. Cu toate acestea, reacțiile care au loc la electrozi sunt în mod esențial diferite de reacțiile în săruri topite. Astfel, la catod în loc de ioni de potasiu (în tensiune rând este de el din aluminiu) recuperarea unei molecule de apă. soluție de electroliză Schema KJ cu electrozi de carbon prezentate în Fig.
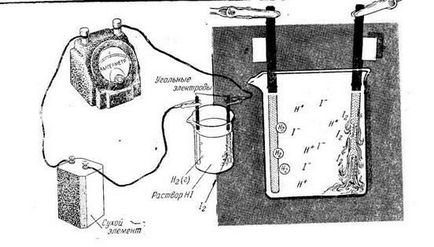
KJ Schema de electroliză (soluție)
Schema de electroliză KJ → K + + J -
Schema generală a procesului de electroliză KJ 2 + 2H2O → H2 ↑ + 2KOH + J2 ↑.
Ca rezultat al electrolizei la hidrogenul catodic este eliberat la anod - iod se acumulează în hidroxid de potasiu spațiu catodic.
Electroliza de sulfat de potasiu cu electrozi de carbon. Deoarece potasiu în seria electrochimică este semnificativ mai devreme decât hidrogenul, atunci catod va recupera apa, se acumulează și eliberează ioni de hidrogen OH -. La anod, se acumulează ioni de oxigen și H +. Cu agitare, aceasta va fi o soluție neutră. electroliză de conducere
Schema totală a procesului de electroliză
Electroliza unei soluții apoase de sulfat de potasiu este redus la apa electrolizată