Cum se calculează procentul randamentului în chimie
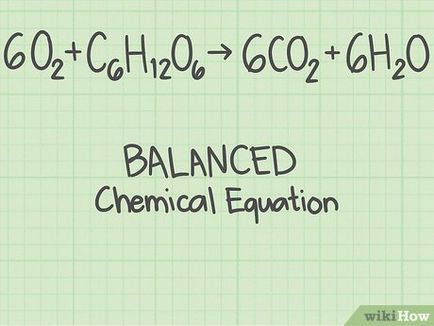

- De exemplu, prin reacția oxigenului si glucoza dioxidului de carbon produs și oxigen: 6 O 2 + C 6 H 12 O 6 + C_H_O_> → 6 C O 2 + 6 H 2 O + 6H_O>
Pe fiecare parte a semnului egal sunt 6 atomi de carbon (C), 12 atomi de hidrogen (H) și 18 atomi de oxigen (O). Ecuația este echilibrată. - Citiți acest articol dacă trebuie să dețină sarcina de a scrie o ecuație echilibrată.
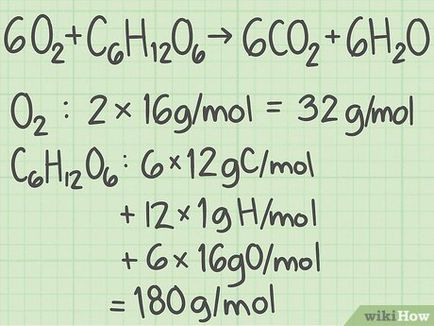
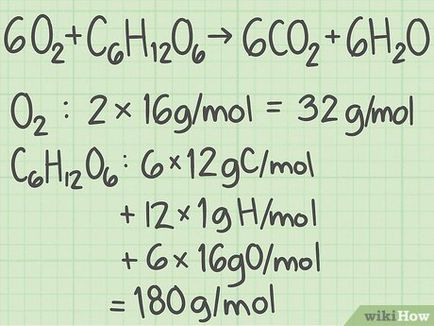
- De exemplu, într-o moleculă de oxigen (O 2>) doi atomi de oxigen.
- masa molara de oxigen este aproximativ egală cu 16 g / mol (a se vedea valoarea curentă în tabelul periodic).
- 2 atom de oxigen x 16 g / mol = 32 g / mol O 2>.
- masa molara a celuilalt reactant, glucoză (C 6 H 12 O 6 H_O_>), este: (6 atomi de carbon x 12 g / mol) + (12 atomi de hidrogen x 1 g / mol) + (6 atomi de oxigen x 16 g / mol ) = 180 g / mol.
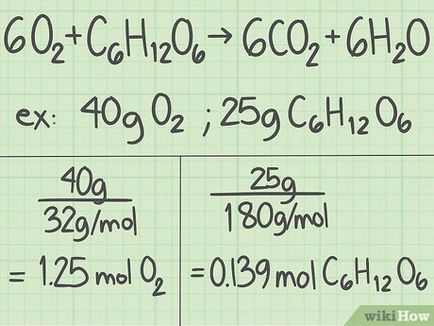

Conversia greutatea fiecărui reactant în grame moli. Acum, ia în considerare reacția pe care aveți de gând să-și petreacă. Se înregistrează greutatea fiecărui reactant în grame. Valoarea rezultată Decalajul de masa molară a unei substanțe de a transforma un gram moli. [2]
- De exemplu, aveți 40 g de oxigen și 25 g de glucoză.
- 40 g de O 2> / (32 g / mol) = 1,25 mol de oxigen.
- 25 g C 6 H 12 O 6 H_O_> / (180 g / mol) ≈ 0,139 mol glucoză.
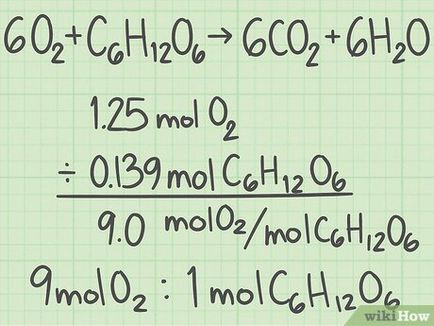
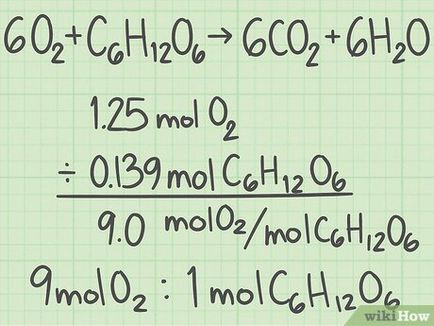
- Ai luat 1,25 mol de oxigen și 0,139 mol de glucoză. Raportul molar dintre oxigen și glucoză 1,25 / 0,139 = 9. Aceasta înseamnă că, pe de o molecula de glucoza scade 9 molecule de oxigen.
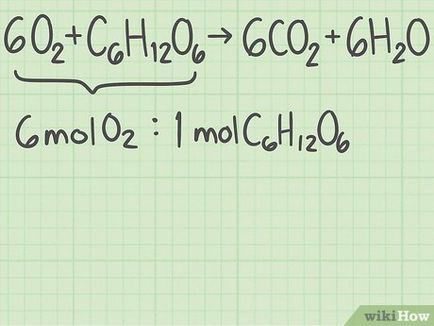
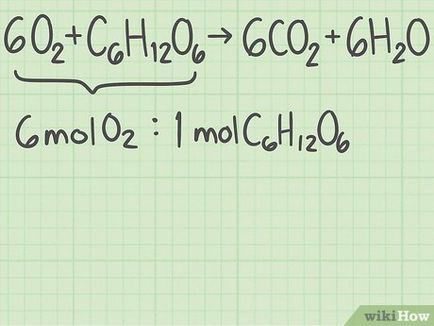
- Partea stângă a ecuației 6 O 2 + C 6 H 12 O 6 + C_H_O_>. Aceasta este, per 1 moleculă de molecule de glucoză 6 oxigen cad. Raportul optim al reactanților: oxigen 6/1 glucoza = 6.
- A nu se confunda substanțele care sunt în numărătorul și numitorul fracției. Dacă vom împărți oxigen la glucoză, și apoi glucoză la oxigen, veți obține un rezultat incorect.
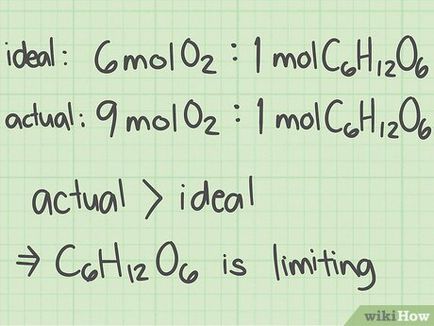
- Dacă raportul molar este mai mare optim, o substanță care este în numărător, de asemenea. Astfel, o substanță care este în numitorul este reactiv cheie.
- Dacă raportul molar este mai mică decât optimă, o substanță care este în numărătorul, este prea mic și este reactiv cheie.
- În acest exemplu, raportul molar (oxigen / glucoză = 9) peste raportul optim (oxigen / glucoză = 6). Astfel, o substanță care este în numitorul (glucoza), un reactiv cheie.