compuși complecși
Compușii complecși sunt compuși moleculare sau ionice formate prin aderarea la atomul de ioni sau metal sau metaloid, molecule neutre sau alți ioni. Ei sunt capabili să existe într-un cristal și în soluție.
termeni și concepte de bază ale teoriei coordonării.
Pentru a explica structura și proprietățile compușilor complecși în 1893 de chimistul elvetian Werner a fost propus teoria de coordonare în care a introdus două concepte: coordonarea și valență auxiliare.
Prin Werner principal valenței numit valență prin care atomii sunt legați pentru a forma compuși mai simpli supunându teorie
valență. Cu toate acestea, epuizantă atomul de valență principal poate tinde la legătura în continuare prin manifestări valența rezultat incidental care se formează compusul complex.
Sub acțiunea forțelor și principalele atomii de valență auxiliare tind să se înconjoare ioni sau molecule uniform și sunt, prin urmare, centrul de greutate. Astfel de atomi se numesc agenți centrale sau de complexare. Ioni sau molecule sunt direct legate de agentul de complexare, numit liganzi.
Prin valență principal ionii liganzi sunt atașați, și prin valență auxiliară - ioni și molecule.
Atracția ligandului la o coordonare chelator numit, iar numărul de ligand - un număr de coordinare de agent de complexare.
Se poate spune că compusul complex este un compus a cărui molecule sunt compuse dintr-un atom central (sau ion) este direct asociat cu un anumit număr de alte molecule sau ioni numite liganzi.
În rolul complexeze cationi metalici acționează adesea (Co +3. Pt +4. Cr + 3. Cu + 2 + 3 Au și colab.)
Ligandul poate acționa ca ionii Cl -. CN -. NCS -. NO2 -. OH -. SO4 2- și molecule neutre de NH3. H2O, amine, aminoacizi, alcooli, tioalcoolilor PH3. esteri.
Numărul de site-uri de coordonare ocupate de ligandul de complexare aproximativ se numește capacitatea de coordonare sau crestat.
Liganzi atașate la o singură legătură chelator, ocupă un loc de coordonare sunt numite monodentatnymiya (Cl. - CN -. NCS -). În cazul în care ligandul este atașat la chelator prin mai multe conexiuni, acesta este un multidentați. De exemplu: SO4 2-. CO 3 2- sunt bidentat.
Și liganzi de complexare constituie compusul sferă interioară sau complex (un complex de formule închise în paranteze pătrate). Ionii nu sunt asociate în mod direct cu kompleksoobrazvatelem constituie sfera de coordonare exterioară.
Ioni sferei exterioare sunt legate mai puternic în comparație cu liganzi și spațial îndepărtat din agentul de complexare. Ele sunt ușor înlocuite cu alți ioni în soluții apoase.
De exemplu, în compusul K3 [Fe (CN) 6] complexant este Fe +2. Liganzi - CN -. Cei doi liganzi sunt atașate datorită valenței principale și 4 - datorită valență secundare, prin urmare, numărul de coordonare este de șase.
Fe + 2 ion cu liganzi CN - constituie sfera interioară sau complex. și K + ioni sferă de coordonare exterioară:
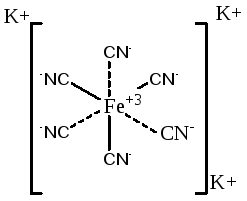
De obicei numărul de coordonare egală cu dublul sarcina cationului metalic, cum ar fi încărcat individual cationii au un număr de coordinare de 2, 2-încărcătoarele - 4 și 3 încărcătoare - 6. Dacă elementul prezintă o stare de oxidare variabilă, cu o creștere de coordonare a acestuia număr crește. Pentru o anumită coordonare complexare număr este constant, de exemplu: Peste trei. Pt 4. Cr 3 au un număr de coordonare 6, y În +3 ioni. Fii +2. Cu + 2. Au număr +3 coordonare este 4. mai număr coordonare ion este variabilă și depinde de natura ionilor și sfera exterioară a condițiilor de formare complexe.