Ce proprietăți de amoniac și amoniac formula
Amoniacul - compus este o sursă importantă de azot pentru organismele vii, și-au găsit aplicații în diferite industrii. Ce este amoniacul, care sunt proprietățile sale? Să recunoaștem.
Ce este amoniacul: Caracteristici de bază
Amoniacul (conducta nitrură) - compus de azot cu hidrogen, având formula chimică NH3. Forma moleculei seamănă cu o piramidă trigonală, dintre care vârful este un atom de azot.
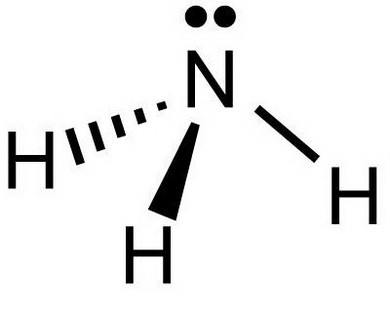
Amoniacul este un gaz care are nici o culoare, dar care au un miros specific ascuțit. Densitatea de amoniac este de aproape două ori mai mică decât densitatea aerului. La o temperatură de 15 ° C este de 0,73 kg / m 3. Densitatea amoniacului lichid în condiții normale este de 686 kg / m 3. Greutatea moleculară a substanței - 17,2 g / mol. O trăsătură distinctivă a amoniacului este solubilitatea sa ridicată în apă. Astfel, la o temperatură de 0 ° C, se ajunge la o valoare de aproximativ 1200 de volume într-un volum de apă la 20 ° C - 700 volume. O soluție de „amoniac - apă“ (apă amoniac) are o reacție ușor alcalin și proprietăți relativ unice în comparație cu alte substanțe alcaline: cu creșterea concentrației de densitate este redusă.
Cum de a produce amoniac?
Ce este amoniacul în corpul uman? Acesta este produsul final al metabolismului azotului. O mare parte din ficat pentru a transforma ureea (carbamidă) - mai puțin substanță toxică.
Amoniacul în mediul natural format prin descompunerea compușilor organici conținând azot. Pentru utilizare în industria este o substanță obținută prin sinteză.
Prepararea de amoniac în condiții industriale și de laborator
amoniacul produs prin sinteză industrial catalitică de azot și hidrogen:
Procesul de obținere a substanței este efectuată la o temperatură de 500 ° C și o presiune de 350 atm. Drept catalizator de fier poros utilizat. Amoniacul rezultat este îndepărtat prin răcire. Azot și hidrogen, care nu a reacționat sunt returnate la sinteza.
În condiții de laborator, amoniacul se prepară în mod esențial prin slab încălzirea unui amestec format din clorură de amoniu și var hidratat:
Gata pentru drenarea compus este trecut printr-un amestec de hidroxid de sodiu și var. amoniac uscat suficient poate fi preparată prin dizolvarea de sodiu metalic în acestea și distilarea ulterioară.
Atunci când se utilizează amoniac?
nitrura de hidrogen este utilizat pe scară largă în diferite industrii. Cantități uriașe de ea sunt utilizate pentru producerea de acid azotic și diverse îngrășăminte (uree, azotat de amoniu, etc.), Polimeri, acid cianhidric, sodiu, săruri de amoniu, precum și alte tipuri de produse chimice.

Proprietăți ale industriei ușoare de amoniac utilizate pentru curățarea și colorarea țesăturilor, cum ar fi mătase, lână și bumbac. În industria oțelului, este utilizat pentru a crește oțelul durității prin saturare cu straturi de suprafață cu azot. In industria petrochimică, folosind azotură de hidrogen deșeuri acide neutralizate.
Datorită proprietăților lor termodinamice, amoniacul lichid este utilizat ca agent frigorific în echipamentele de refrigerare.
O soluție de nitrura de hidrogen (amoniac) este utilizat în medicină pentru îndepărtarea sincopă, vărsături stimulare, pentru tratamentul mâinilor personalului medical, înțepături de insecte, și așa mai departe.

Unele proprietăți chimice ale amoniacului
hidrogen nitrura caracterizat printr-o activitate chimică relativ ridicată și poate reacționa cu multe substanțe.
Când amoniacul reacționează cu acizii pentru a se obține sarea de amoniu corespunzătoare. Astfel, de exemplu, prin reacția cu acid azotic, azotat de amoniu se formează:
Atunci când interacționează cu clorura de amoniu formată HCI:

Sărurile de amoniu sunt substanțe cristaline solide, descompunerea în apă și având proprietățile inerente sărurilor metalice. Soluțiile de compuși formați prin reacția amoniacului și acizi puternici au o reacție slab acidă.
Datorită atomului de azot este un reducator activ nitrura de hidrogen. Reducerea proprietăților de manifest atunci când este încălzit. Atunci când este arsă într-o atmosferă de oxigen, se formează un azot și apă. În prezența catalizatorilor în reacție cu oxigenul furnizează un oxid de azot. hidrogen nitrură are capacitatea de a recupera metalele din oxizi.
Halogenuri prin reacția cu amoniac pentru a forma halogenurile de azot - explozivi periculoase. Prin reacția cu acizi carboxilici și derivați de nitrura de formă hidrogen amidele lor. În reacțiile cu cărbune (la 1000 ° C) și metan dă acidul cianhidric.
Deoarece ionii metalici care formează complecși amino, amoniac, ammoniates sau (compus complex) având o caracteristică: atomul de azot este întotdeauna legat la trei atomi de hidrogen. Ca urmare a modificărilor complexe de substanțe colorante. Astfel, de exemplu, soluție de albastru de sulfat de cupru cu adaos de nitrură de hidrogen capătă o culoare albastru-violet intens. Multe dintre complexele amino posedă suficientă stabilitate. Din acest motiv ele pot fi preparate sub formă solidă.

Amoniacul lichid este bine solubil atât ionic și compuși organici și anorganici nepolare.
caracteristici de salubritate
Efectul asupra organismului uman
Ce este amoniacul în ceea ce privește expunerea umană? Acesta substanță toxică. Aceasta se referă la o substanță capabilă să exercite acțiunea sufocantă și neurotrop, intoxicații prin inhalare care poate duce la edem pulmonar și leziuni ale sistemului nervos.
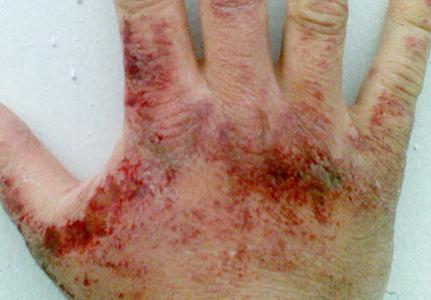
vapori de amoniac efect asupra pielii, membranele mucoase ale ochilor și organelor respiratorii iritant. Concentrația de substanță, la care se manifestă iritația gâtului, este de 280 mg per cc. metru ochi - 490 mg per metri cubi. metru. În funcție de cantitatea de hidrogen din nitrura de aer se poate produce dureri în gât, dificultăți de respirație, tuse, durere la nivelul ochilor, hiperlacrimație excesivă, arsuri chimice ale corneei, pierderea vederii. Atunci când conținutul de amoniac de 1,5 g per cu. metru pe oră edem pulmonar toxic se dezvolta. La contactul cu amoniac lichid și soluțiile sale (în concentrații mari) de posibila înroșire a pielii, mâncărime, arsuri și dermatite. Deoarece lichefiată conducta de nitrură absoarbe căldura în timpul evaporării sunt posibile grade degerături variabile.
intoxicații amoniac Simptome
Substanța toxică date otrăvire pot provoca o scădere prag, greață, amețeli, dureri de cap de auz, și așa mai departe. Există modificări de comportament, în special agitație puternică, delir. Manifestarea simptomelor, în unele cazuri, este intermitentă. Ele pot opri pentru un timp și apoi reluată cu o vigoare reînnoită.
Luând în considerare toate consecințele posibile ale expunerii la amoniac, este important să se ia măsuri de precauție atunci când se lucrează cu substanța și să nu depășească concentrația în aer.
